С чем взаимодействует алюминий
Если Вы достаточно хорошо помните школьный курс химии, то наверняка знаете – характер и род химических реакций элемента предопределен положением, которое он занимает в таблице Менделеева. Это утверждение на все 100% касается алюминия, но с особенностями его поведения как химического элемента стоит разобраться более детально.
Краткая характеристика
Спросите у любого школьника и он ответит, что алюминий – это легкий металл, имеющий светло-серый цвет (близкий к серебристому). Легко поддается обработке, можно вытянуть в достаточно тонкую проволоку или прокатит до состояния тонкого листа.
Как правило, для дополнительной защиты поверхности или изделий, покрывает тонкая оксидная пленка. За счет наличия этой пленки, изделия из этого металла или его сплавов не меняются при воздействии различных температур.
Особенности взаимодействия с различными веществами
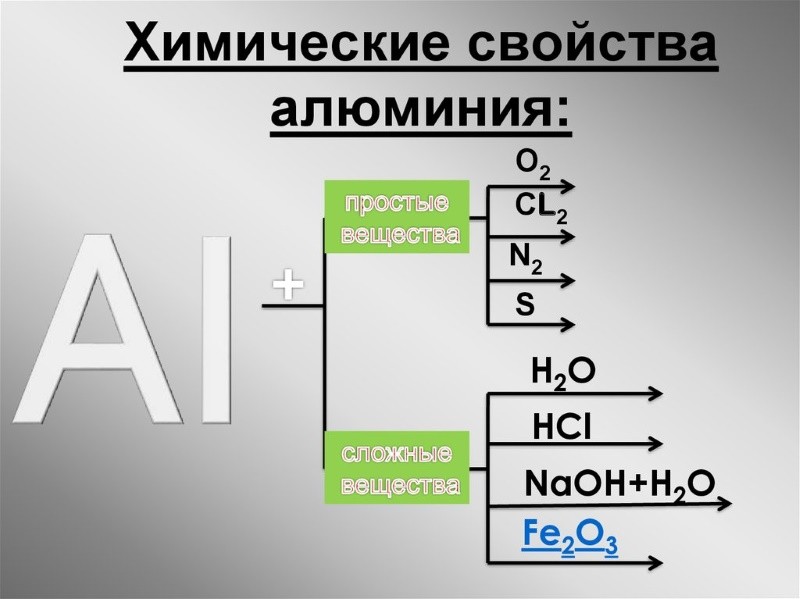
Алюминий является достаточно активным в плане взаимодействия его с другими веществами и химическими элементами. Вещества, с которыми металл взаимодействует, можно разделить на две группы, а именно:
- Простые вещества – это галогены (фтор, хлор, бром и прочие), сера, фосфор, углерод, азот и ещё кислород (то есть реакция горения);
- Реагирует металл также на некоторые сложные вещества – воду, минеральные (соляная, фосфорная), серную и азотную кислоты, щелочи, окислители и оксиды металлов меньшей активности.
Стоит оговориться, что этот металл проявляет эффект пассивации. За счет этого и при обычных условиях никаких реакций не происходит с концентратами серной или азотной кислот. Однако о некоторых особенностях поведения этого химического элемента стоит поговорить более развернуто.
Удивительнее всего звучит то, что металл горит (взаимодействие с воздухом). Как бы в это не было сложно поверить, но это так. Алюминиевые изделия или поверхности большую часть времени покрыты оксидной пленкой, однако при незначительном повреждении металл можно начать гореть ярким белым пламенем. Это происходит за счет открытия чистого металла, на который сразу начинает влиять воздух, а результатом будет образование оксида.
Что касается взаимодействия с водой, то выход будет более разнообразным. Кроме оксида, в двух вариантах может быть образован гидроксид (байерит или богемит). Также при этих процессах выделяется большое количество водорода и тепла. Кроме этого, тип выделяемого вещества зависит от температуры, при которой это происходит. В бытовых условиях это реализовать невозможно.
Как сказано выше кислотами в концентрированном виде металл не реагирует, но совершенно иное дело их растворы. Результатом их воздействия будут соли в соответствии с видами перечисленных ранее кислот. Чтобы определенные реакции произошли при использовании концентрированных кислот, следует использовать высокие температуры.
Относительно щелочей, то для происхождения определенных реакций используются их растворы. В результате выделяется сложное соединение и водород. Определенных условий для происхождения взаимодействия нет.
Полный перечень возможных вариантов реагирования алюминия можно найти в учебниках по химии. Однако понаблюдать за реактивными эффектами в бытовых условиях не предвидится, поскольку нет вероятности случайного создания необходимой среды.
Также все перечисленное выше в какой-то степени относится и к алюминиевым сплавам. Однако используемые дополнительные компоненты несколько изменяют поведение металла по отношению к другим веществам. Реактивные изменения происходят, побочные вещества выделяются, однако они будут иметь другие особенности.

